Les piles
I ) Transfert d'électrons :
Dans le chapitre précédent, on a constaté que le transfert spontané et direct d'électrons du réducteur vers l'oxydant est possible.
Si on sépare les espèces chimiques, on peut réaliser un transfert spontané et indirect du réducteur vers l'oxydant en les reliant par un conducteur métallique.
C'est le principe d'une pile
II ) Constitution d'une pile électrochimique :
1) Définition :
Une pile électrochimique est un générateur qui transforme de l'énergie chimique fournie par une réaction d'oxydoréduction spontanée en énergie électrique.
2) Description :
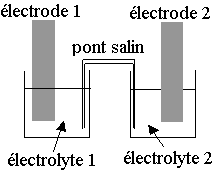 Une
pile est composée de :
Une
pile est composée de :
* Deux compartiments séparés appelés demi-piles contenant chacun une électrode (matériau conducteur, en général des métaux ou du carbone) et une solution électrolytique
* Un pont salin ou une paroi poreuse reliant les 2 demi-piles.
Chaque demi-pile est composée des espèces d'un couple oxydant/réducteur.
Souvent le couple est formé d'un ion métallique Mn+ et du métal
M.
L'électrode alors constituée du métal M.
Dans certains cas, l'électrode est constituée d'un matériau conducteur inerte.
L'oxydant et le réducteur du couple sont alors dans la solution.
Le pont salin est constitué d'un tube en U creux rempli d'une
solution gélifiée conductrice concentrée (ou d'une simple feuille de papier
imbibé d'une solution conductrice).
Les ions présents dans le pont salin (en général K+ et Cl-
ou NO3-) n'interviennent pas dans la réaction d'oxydoréduction.
Leur rôle est de permettre le passage du courant dans la pile et d'assurer la neutralité électrique des solutions.
3) Exemple : Pile Daniell
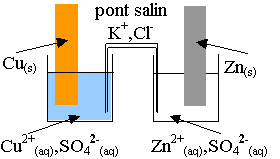
On associe une demi-pile de couple Cu2+ /Cu et
une demi-pile Zn
2+ /Zn reliées par un pont salin .
Dans un bécher contenant une solution de sulfate de cuivre(II) à 0,10mol.L-1
, trempe une lame de cuivre et dans un autre bécher contenant une solution
de sulfate de zinc à 0,10mol.L-1, trempe une lame de zinc.
Dans la pile inventée par M. Daniell, le pont salin est remplacé par une paroi
poreuse.
III ) Fonctionnement de la pile :
1) Etude expérimentale :
Si on relie les électrodes de la pile par un circuit comprenant en série, une résistance R et un ampèremètre , celui-ci indique le passage d'un courant, la pile débite.
C'est un générateur .
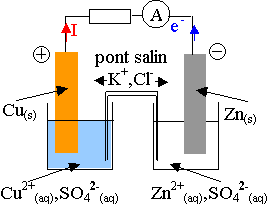 On peut ainsi connaître
le sens du courant et déterminer la polarité de la pile, pôle (+)
et pôle (-)pour chaque électrode.
On peut ainsi connaître
le sens du courant et déterminer la polarité de la pile, pôle (+)
et pôle (-)pour chaque électrode.
Rappel : le courant sort du pôle (+) du générateur et rentre au pôle (-) du générateur.
Dans le cas de la pile Daniell , le courant sort de l'électrode de cuivre , pôle (+)et rentre à l'électrode de zinc, pôle (-) .
Attention, l'ampèremètre se branche en série, à la suite
d'un composant. Le courant doit entrer par la borne A et sortir par la borne
COM, sinon l'ampèremètre indique un signe négatif, cela signifie que
le courant circule en sens inverse.
expérience : pile Daniell avec paroi poreuse : R = 10 Ω
U0 = 1,07 V et I = 25 mA
2) Mouvement des porteurs de charges :
Les porteurs de charges sont des entités qui en se déplaçant, assurent le passage du courant.
Lorsque la pile débite, les porteurs de charges sont de deux sortes :
* Dans le circuit extérieur à la pile, ce sont des électrons qui circulent dans les fils et les conducteurs de la borne (-) vers la borne (+).
* Dans le pont salin et dans les solutions, ce sont des
ions qui se déplacent. Le mouvement des ions dans le pont salin permet aux
solutions de rester électriquement neutres.
Dans la demi-pile où se forment des cations (électrode négative) le pont salin
apporte de anions et dans la demi-pile où les cations sont consommés (électrode
positive) le pont salin apporte des cations.
La pile est bien un circuit fermé, condition indispensable pour le passage du courant.
3) Les réactions de chaque demi-pile et de la pile :
a) Pile Daniell :
* L'électrode de zinc est le pôle (-), elle
donne des électrons e- au circuit :
Zn(s)=Zn2+(aq)+2e-
Il y a oxydation de Zn en Zn2+.
* L'électrode de cuivre est le pôle (+), elle
capte les électrons cédés : Cu2+(aq) + 2e-
= Cu(s)
Il y a réduction de Cu2+ en Cu.
* Bilan : Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
b) Généralisation : couples Ox1/Red1 et Ox2/Red2
A la borne (-), il y a oxydation du réducteur 1 : a Red1 = b Ox1 + n1 e-
A la borne (+), il y a réduction de l'oxydant 2 : c Ox2 + n2 e- = d Red2
Bilan : ( a Red1 = b Ox1 + n1e- ) x n2
( c Ox2 + n2e- = d Red2 ) x n1
a.n2 Red1 + c.n1 Ox2 = b.n2 Ox1 + d.n1 Red2
4) Critère d'évolution spontanée
On peut utiliser le critère d'évolution spontanée pour déterminer les pôles (+) et (-) de la pile.
La réaction de la pile est caractérisée par une constante d'équilibre K.
Le système est caractérisé par le quotient de réaction Qr .
Lorsque la pile débite, les quantités des espèces chimiques changent, Qr change, le système est hors équilibre.
exemple : pile Daniel avec solutions de concentrations 0,10 mol.L-1
Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s) K = 2.1037 , Qr = [Zn 2+ ]i / [Cu2+ ]i = 0,10 / 0,10 = 1,0 < K
Le système évolue dans le sens direct. L'électrode de zinc donne des électrons, c'est le pôle (-).
L'électrode de cuivre capte les électrons, c'est le pôle (+).
5) Représentation formelle d'une pile :
a) Cas de couples de la forme Mn+ / M ( M métal servant d'électrode).
La représentation formelle de la pile est obtenue en plaçant
la borne (-) à gauche, la borne
(+)
à droite et en indiquant les espèces chimiques rencontrées dans la pile.
Le pont salin (ou la paroi poreuse) est représenté par une double barre //
.
(-)M / Mn+ // Mp+ / M (+) ex : (-) Zn / Zn2+ // Cu2+ / Cu (+)
b) Cas de couples sans métal :
L'électrode est alors constituée d'un conducteur inerte (le platine Pt ou le carbone).
(-)Pt / Red1 / Ox1 // Ox2 / Red2 / C (+) (-) Pt / Fe2+ / Fe3+ // Ag+ / Ag / C (+)
IV ) Grandeurs caractéristiques :
1) Force électromotrice E et résistance interne r :
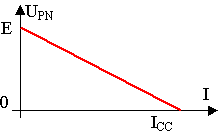 La caractéristique
intensité-tension d'une pile est le graphique représentant UPN
en fonction de I .
La caractéristique
intensité-tension d'une pile est le graphique représentant UPN
en fonction de I .
( voir T.P.)
Son équation est : UPN = E – r I.
E est la force électromotrice (f.e.m) de la pile, mesurée
en volt(V).E > 0
C'est la tension aux bornes de la pile lorsqu'elle ne débite pas ( I = 0 A).
Pour la mesurer, on branche un voltmètre aux bornes de la pile hors circuit,
E est la valeur absolue de la mesure.
r est la résistance interne de la pile, mesurée en ohm (Ω).
Elle est égale à l'opposé du coefficient directeur de la caractéristique intensité-tension.
ICC est le courant de court-circuit.
Pour une pile Leclanché, E = 1,5 V ; r = 0,50 Ω ; Icc = 3,0 A
2) Capacité en charge de la pile :
a) Quantité d'électricité débitée :
Lorsqu'une pile débite un courant d'intensité I constante pendant une durée t , la quantité d'électricité Q vaut :
Q = I . t Q en coulomb (C) (parfois en Ah ) , I en ampère (A) et t en s.
ex : pile I = 100 mA , t = 30 s , Q = 3,0 C = 8,3.10-4 A.h
On appelle capacité de la pile, la quantité maximale d'électricité fournie Qmax par la pile :
Qmax = I . tmax
Lorsque la pile débite, Qr évolue jusqu'à atteindre la constante d'équilibre K. La pile est alors usée.
Soit n la quantité de matière d'électrons échangés pendant tmax, Qmax = n.NA.e
NA : nombre d'Avogadro (NA=6,02.1023mol-1) ; e : quantité d'électricité transportée par un électron
Le produit NA.e est appelé faraday et noté F. 1 F = NA.e = 6,02.1023 x 1,6.10-19 = 96320 C.mol-1
On utilise souvent 1 F ≈ 96 500 C.mol-1 Qmax = n . F
b) Calcul de n :
Pour les calculs, on utilise les demi-équations pour relier les quantités de matière consommées ou produites à n.
Demi-équations : a Red1 = b Ox1 + n1e- et c Ox2 + n2e- = d Red2
Si on tient compte de la disparition de Red1, n = n1.n(Red1)consommés/a
Si on tient compte de la disparition de Ox2 , n = n2.n(Ox2)consommés/c
Si on tient compte de la formation de Ox1 , n = n1.n(Ox1)formés/b
Si on tient compte de la formation de Red2 , n = n2.n(Red2)formés/d
On peut alors calculer I : I = Q / t = n . F/ t
Inversement, connaissant I et t, on peut calculer n et les quantités consommées ou formées.
Pour déterminer la capacité de la pile Qmax , il faut déterminer xf l'avancement final.
xf peut être atteint lorsque l'équilibre est atteint ( Qr = K ) ou lorsqu'un des réactifs a été complètement consommés, on tient alors compte de la quantité initiale du réactif limitant.
Remarque : Une pile n'est pas rechargeable contrairement à un accumulateur. Le terme "pile rechargeable" ne devrait pas être utilisé à la place d'accumulateur.
V ) Exemple de pile : La pile Leclanché ou pile saline :
* 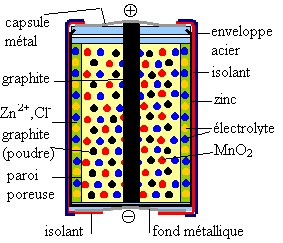 Le pôle négatif est constitué par le métal zinc Zn qui est en contact avec
du chlorure de zinc en solution aqueuse gélifiée Zn2++2Cl-.
(couple Zn2+/Zn)
Le pôle négatif est constitué par le métal zinc Zn qui est en contact avec
du chlorure de zinc en solution aqueuse gélifiée Zn2++2Cl-.
(couple Zn2+/Zn)
* L'électrolyte est une solution acide gélifiée de chlorure d'ammonium NH4+ + Cl-.
* Le pôle positif est un bâton de graphite (carbone). C'est une électrode inerte en contact avec du dioxyde de manganèse, oxydant du couple MnO2 / MnO(OH).
* Le graphite en poudre assurent une meilleure conduction.
Demi-équations :
Zn(s) = Zn2+(aq)+2e- et MnO2 (s)+H+(aq)+e- = MnO(OH)(s)
Bilan : Zn(s)+ 2MnO2 (s)+2H+(aq) = Zn2+(aq)+2MnO(OH)(s)
La force électromotrice proche de 1,5V. Le réactif en défaut est le dioxyde de manganèse.
Cette pile est dite "sèche" car elle ne contient pas de liquide mais un gel évitant à la pile de couler.
L'électrolyte de la paroi poreuse est un sel, pour cette raison, la pile est dite "pile saline".
Dans d'autres piles dites "piles alcalines", l'électrolyte est basique (alcalin), par exemple une solution gélifiée d'hydroxyde de potassium (K+ + HO-).
Les piles bouton plus énergétiques sont à l'oxyde d'argent : (-) Zn / ZnO // Ag2O / Ag / C (+)
